Nella prima parte abbiamo trattato il duplice ruolo dell’IFNγ nel TME, ora ci concentreremo su alcune tipologie di cellule che producono IFNγ.
Numerose sottopopolazioni di cellule immunitarie producono IFNγ nel microambiente tumorale (TME). Per una trattazione più chiara e meno prolissa ci occuperemo solo di alcune tipologie di cellule: come alcuni sottotipi di cellule T, delle cellule Natural Killer (NK) e delle cellule B. Per chi volesse un approfondimento ulteriore è possibile consultare il paper in cui sono riportate tutte le altre categorie di cellule immunitarie di interesse.
Sebbene l’IFNγ abbia effetti pleiotropici, la produzione di IFNγ da parte delle cellule immunitarie è generalmente antitumorigenica piuttosto che protumorigenica. Tuttavia l’attività dell’IFNγ può essere modificata da altre citochine citotossiche presenti nel microambiente tumorale (TME).
Analizziamo ora alcune tipologie di cellule che producono IFNγ:
- Cellule T effettrici
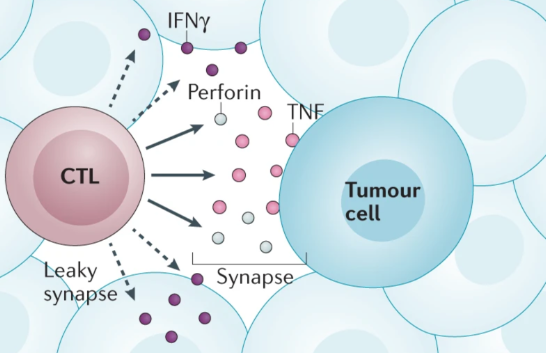
I linfociti T citotossici CD8+ (CTL) sono noti produttori di IFNγ e sono fondamentali per l’attività antitumorale. Oltre ad esprimere IFNγ producono anche altre molecole come la perforina, i granzimi, il fattore di necrosi tumorale (TNF) e l’interleuchina 2 (IL-2).
Quando la cellula T si attiva è stimolato il rilascio di IFNγ in modo tale che il segnale di IFNγ raggiunga sia la cellula bersaglio sia le cellule vicine. Questa modalità di secrezione di IFNγ è diversa da quella delle altre molecole citotossiche come il TNF e la perforina, che si concentrano solamente nella sinapsi immunologica, la zona di contatto tra cellula T e cellula bersaglio, per mediare in questo caso l’uccisione delle cellule tumorali.
I risultati ottenuti dai ricercatori illustrano l’importanza della produzione di IFNγ da parte delle cellule T citotossiche CD8+ nel mediare sia effetti benefici, diffusi e duraturi, di uccisione delle cellule tumorali e sia effetti pro-infiammatori nel TME.
- Cellule T “TH1”
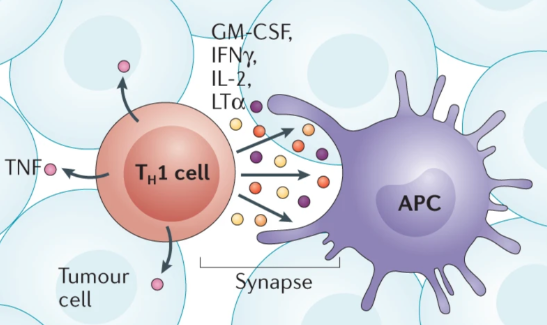
L’IFNv è anche la citochina caratteristica delle cellule TH1 che producono anche il TNF e l’IL-2.
Il rilascio di IFNγ e IL-2 è unidirezionale e determina segnali di sopravvivenza a specifiche cellule immunitarie, le APC. Al contrario, nel TME il TNF viene rilasciato dalle cellule TH1 in modo multidirezionale per promuovere l’attivazione di determinate cellule immunitarie, i macrofagi. L’importanza delle cellule TH1 nella TME è stata dimostrata in un modello di carcinoma polmonare di topo in cui il passaggio da una TME ricca di cellule TH2, un’altra tipologia di cellule T, a una TME dominata dalle cellule TH1 ha favorito l’eliminazione del tumore con immunoterapie combinatorie, ossia che vedono l’impiego di più farmaci.
- Cellule NK
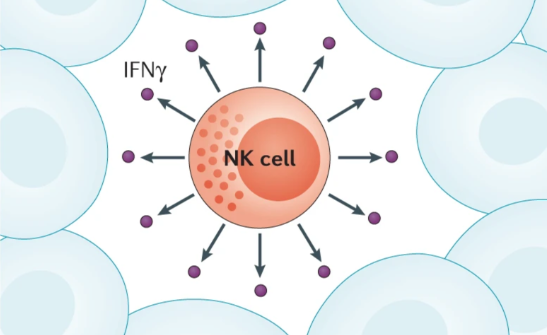
Le cellule NK sono cellule citotossiche del sistema immunitario che costituiscono la prima linea di difesa contro la crescita tumorale.
I dati raccolti su queste cellule suggeriscono che le loro funzioni anti-tumorigeniche siano attivate proprio dall’IFNv.
Le cellule NK presentano dei recettori inibitori che le mantengono in uno stato di non attivazione e recettori attivatori che invece attivano la cellula NK che può cosi svolgere la sua azione citotossica, eliminando così le cellule bersaglio.
Questa tipologia di cellule riconosce determinati bersagli come le cellule tumorali e media gli effetti citotossici attraverso la produzione di IFNγ, inoltre la presenza delle cellule NK all’interno del microambiente tumorale è collegata con una miglior prognosi nei pazienti oncologici. La presenza delle cellule NK potrebbe essere usata in diagnostica, come suggerito da Jongmi Lee e i suoi collaboratori che nel 2017 hanno pubblicato un articolo riguardante un possibile test diagnostico che misuri l’attività delle cellule NK nel sangue per la produzione di IFNγ nei pazienti con cancro gastrico. Tale metodo potrebbe diventare un’ulteriore via non invasiva per monitorare la progressione della malattia.
- Cellule B
Oltre alla capacità di produrre anticorpi, le cellule B hanno funzioni indipendenti dagli anticorpi attraverso la secrezione di citochine. Un sottogruppo di cellule B produce IFNγ durante le prime fasi dell’infezione batterica, in modo analogo alle cellule NK, grazid all’espressione del recettore per l’IFNγ (IFNGR). Tuttavia, il ruolo di questo sottogruppo di cellule B nel TME e il modo in cui IFNγ viene rilasciato sono ancora sconosciuti.
Ad oggi ci sono molte altre domande chiave che meritano di essere approfondite, per esempio, quali cellule produttrici di IFNγ siano più importanti per gli effetti antitumorali?, quali cellule esprimenti IFNγ nel TME mediano la resistenza all’immunoterapia? e come l’IFNγ possa essere introdotto per rendere “caldi” i tumori “freddi”?, cioè trasformare i tumori che non vedono la presenza di cellule immunitarie e citochine nel TME in tumori con questi elementi al loro interno.
Gli studi futuri dovranno utilizzare approcci innovativi per distinguere gli effetti proinfiammatori da quelli antinfiammatori dell’IFNγ, per progettare terapie migliori che ne influenzino le capacità antitumorali e prevengano l’evasione immunitaria.